本期为大家带来的是干细胞领域的z1新研究进展,希望读者朋友们能够喜欢。
1. Cell Stem Cell:重大进展!将人成熟的血细胞直接重编程为一类新的神经干细胞
DOI: 10.1016/j.stem.2018.11.015.
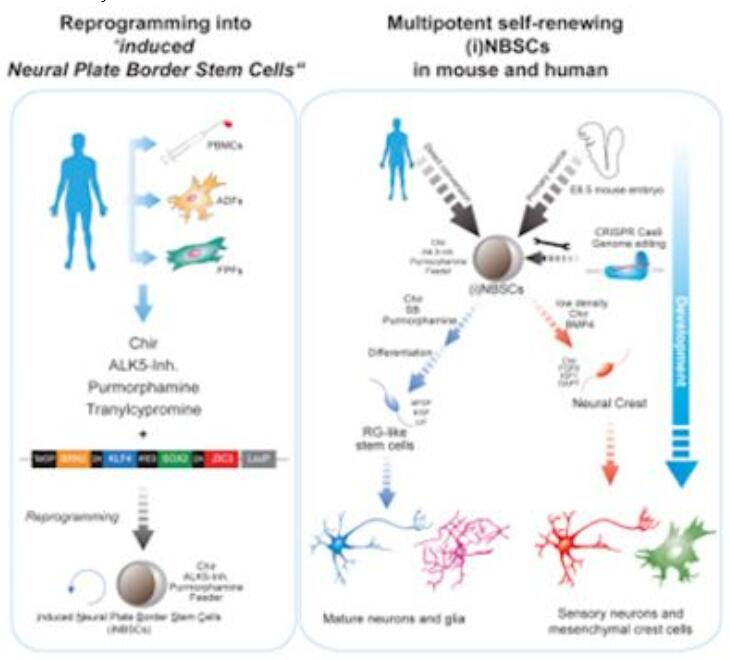
在一项新的研究中,来自德国癌症研究中心(DKFZ)和海德堡干细胞技术与实验医学研究所(HI-STEM)的研究人员首次成功地将人血细胞直接重新编程为一种以前未知的神经干细胞。这些诱导性干细胞类似于在中枢神经系统的早期胚胎发育期间形成的干细胞。它们能够在实验室中进行修饰和无限期地增殖,并且代表着一种用于再生疗法开发的候选对象。相关研究结果于2018年12月20日在线发表在Cell Stem Cell期刊上,论文标题为“Identification of Embryonic Neural Plate Border Stem Cells and Their Generation by Direct Reprogramming from Adult Human Blood Cells”。论文通讯作者为Andreas Trumpp和Marc ChristianThier。
多能性的胚胎干细胞能够无限制地增殖并产生所有可能的细胞类型。2006年,日本科学家Shinya Yamanaka认识到,这样的多能性干细胞也能够在实验室中由成熟的体细胞经重编程后产生。四种遗传因子足以让成熟的体细胞逆转正常的发育过程并产生所谓的与胚胎干细胞具有相同性质的诱导性多能干细胞(ips细胞)。Yamanaka因这一发现于2012年获得诺贝尔医学奖。
Trumpp说,“这是干细胞研究的一个重大突破。这尤其适用于德国的研究,这是因为在那里,产生人胚胎干细胞是不允许的。干细胞在基础研究和开发旨在恢复患者病变组织的再生疗法中具有巨大的潜力。然而,这种重编程也存在着问题:比如,多能性干细胞能够形成称为畸胎瘤的生殖系肿瘤。”
Trumpp团队首次成功地将成熟的人细胞重编程为一种特定类型的能够几乎无限增殖的诱导性神经干细胞,他们称之为诱导性神经板边界干细胞(induced neural plate border stem cell, iNBSC)。Thier解释道,“像Yamanaka那样,我们使用了4种遗传因子,不过使用了4种不同的遗传因子用于我们的重编程中。我们认为,我们的遗传因子将允许重编程到神经系统发育的早期阶段。”
在过去,其他的研究团队也将结缔组织细胞重编程为成熟的神经细胞或神经前体细胞。然而,这些人工产生的神经细胞通常不能增殖,因此不能用于治疗目的。针对这个问题,Trumpp 解释道,“通常而言,这是不同细胞类型的异质混合物,它在生理条件下可能不存在于体内。”
通过与来自奥地利因斯布鲁克大学的干细胞研究员Frank Edenhofer以及来自DKFZ和海德堡大学医院的神经科学家Hannah Monyer一起,Trumpp和他的团队如今成功地将皮肤和胰腺中的结缔组织细胞以及外周血细胞重编程为诱导性神经干细胞。Thier说,“这些细胞的起源对对所产生的干细胞的性质没有影响。”特别地,在没有侵入性干预的情况下利用患者的血液获得神经干细胞的可能性是在未来开发治疗性方法的一个决定性优势。
值得注意的是,这些重编程细胞是同质细胞类型,类似于一种在神经系统的胚胎发育期间存在的干细胞。Thier说,“在早期胚胎大脑发育过程中,相应的干细胞存在于小鼠体内,也很可能存在于人体中。我们在这项研究中描述了哺乳动物胚胎中的一种新的神经干细胞类型。”
这些iNBSC具有广泛的发育潜力。iNBSC具有增殖能力和多能性,能够朝两个方向进行发育。一方面,它们能够选择产生中枢神经系统中的成熟的神经细胞和神经胶质细胞的发育途径。另一方面,它们也能够发育成神经嵴细胞,这些神经嵴细胞产生不同的细胞类型,比如周围敏感性的神经元,颅骨的软骨细胞或骨细胞。
因此,iNBSC成为为个体患者产生多种不同细胞类型的理想基础。Thier解释道,“这些细胞具有与供者相同的遗传物质,因此可能被免疫系统自我识别,并且不会遭受免疫排斥。”
正如这些研究人员在他们的实验中所证实的那样,CRISPR/Cas9基因剪刀可用于修饰iNBSC或修复遗传缺陷。Trumpp说,“因此,它们对于基础研究和寻找新的活性物质和开发再生疗法(比如对患有神经系统疾病的患者而言)都很有意义。但是,在我们将它们用于患者身上之前,开展大量的研究工作仍然是有必要的。”
2. PNAS:实锤!成年心脏并不存在心脏干细胞
doi:10.1073/pnas.1805829115.
在一项新的研究中,荷兰研究人员利用先进的分子和遗传技术构建出在心肌梗塞发作之前和之后成年小鼠心脏中的所有分裂细胞的详细细胞图谱。他们得出结论:成年心脏不含有心脏干细胞。在先前的研究中被鉴定为心脏干细胞的细胞z1终产生血管或免疫细胞,但从未产生心肌。相关研究结果发表在2018年12月26日的PNAS期刊上,论文标题为“Profiling proliferative cells and their progeny in damaged murine hearts”。
在心肌梗塞(通常称为心脏病发作)发作期间,部分心肌的血液供应被切断。结果就是部分心肌死亡。鉴于心脏通过我们的血管维持血液循环,这显然会危及生命。
动物和人类的大多数组织都含有干细胞,当组织遭受损伤时,这些干细胞就会出手加以拯救:它们快速地产生大量的“子细胞”以便替换丢失的组织细胞。
二十年来,科学家们和临床医生一直在寻找应当存在于心肌中的心脏干细胞,这样在心肌梗塞发作后,它们就能够修复受损的心脏。多个研究团队已声称他们明确地鉴定出心脏干细胞,但是这些声称都没有得到证实。因此,心脏干细胞是否存在以及它们在成年心脏中的重要性仍然存在大量争论。
为了解决这一争论,这些研究人员将注意力集中在对小鼠心脏中的干细胞功能的z1广泛和z1直接的定义上:细胞通过细胞分裂替换丢失组织的能力。在心脏中,这意味着在心脏病发作后,任何能够产生新的心肌细胞的细胞就被称为心脏干细胞。他们利用先进的分子和遗传技术,构建出在心肌梗死发作之前和之后的所有分裂心脏细胞的细胞图谱。
这项研究表明一旦心脏遭受损伤,多种类型的细胞发生分裂,但是这些细胞都不能够产生新的心肌。事实上,过去研究中的许多错误结论如今能够加以解释:之前称为心脏干细胞的细胞如今经证实产生血管或免疫细胞,但从未产生心肌。因此,一个清醒的结论是心脏干细胞并不存在。换句话说,由于心脏病发作而丢失的心肌不能被替换。这一发现虽然令人失望,却解决了一个长期存在的争论。
这些研究人员还取得了第二个重要的发现。在心脏中,与心肌细胞一起存在的结缔组织细胞(也称为成纤维细胞)通过发生多次细胞分裂而对心肌梗塞作出强烈的反应。在这样做时,它们会产生替换丢失的心肌组织的瘢痕组织。尽管这种瘢痕组织不含有心肌,因而不会导致心脏的泵血功能,但是这种纤维化的瘢痕组织与梗塞区域“连接在一起”。确实,当这种瘢痕组织的形成受到阻断时,小鼠死于急性心脏破裂。因此,虽然瘢痕组织形成通常被视为心肌梗塞的负面结果,但是他们强调了瘢痕组织形成在维持心脏完整性中发挥着重要作用。
3. Eur J Neurosci:经过CRISPR/Cas9n编辑的干细胞有望治疗帕金森病
DOI: 10.1111/ejn.14286.http://news.bioon.com/article/6731868.html
在英国,帕金森病的发病率大约为1/350。在一项新的研究中,来自英国爱丁堡大学和UCB制药公司(UCB Pharma Ltd.)的研究人员在改善一种新出现的治疗帕金森病的方法上迈出了关键一步。这一进展可能有助于开发一种有希望的称为细胞替代疗法(cell replacement therapy)的疗法。专家们希望这种涉及将健康细胞移植到被帕金森病破坏的大脑区域中的疗法能够缓解震颤和平衡问题等症状。相关研究结果近期发表在European Journal of Neuroscience期刊上,论文标题为“Engineering synucleinopathy‐resistant human dopaminergic neurons by CRISPR‐mediated deletion of the SNCA gene”。
在这项新的研究中,这些研究人员构建出对帕金森病有抵抗力的人胚胎干细胞(hESC)。具体而言,他们利用一种称为CRISPR/Cas9n的先进技术切除hESC中的DNA片段。在这样做的过程中,他们剔除了与有毒性的团块(称为路易小体)形成相关的基因SNCA,其中这种毒性团块形成是帕金森患者中的脑细胞的一种典型特征。
在实验室测试中,这些干细胞在培养皿中可被转化为产生多巴胺的神经元。它们随后在接受一种化学试剂处理后就可导致路易小体形成。这些研究人员发现相比于未经过基因编辑的神经元,经过基因编辑的神经元并没有形成有毒性团块。
这些研究人员表示,这一进展可能对患有帕金森病的年轻患者和患有侵袭性帕金森病的患者是z1有益的,但是它还需在人体试验中进行测试。
论文通讯作者、爱丁堡大学医学研究委员会再生医学中心的Tilo Kunath博士说,“我们知道帕金森病在神经元之间进行扩散并侵入健康细胞。这实际上可能为细胞替代疗法的潜力设置一个使用期限。我们的激动人心的发现有潜力极大地改善这些新出现的疗法。”
帕金森病治愈基金会(Cure Parkinson's Trust)研究副主任Simon Stott博士说,“细胞替代疗法是一种治疗帕金森病患者的实验性再生医学方法。这项新研究在开发这种疗法上提供了新的进展。很高兴的是,帕金森病治愈基金会资助了这项鼓舞人心的创新研究。”

4. Cancer Cell:白血病复发的根源并不在于白血病干细胞而在于白血病再生细胞
doi:10.1016/j.ccell.2018.08.007.
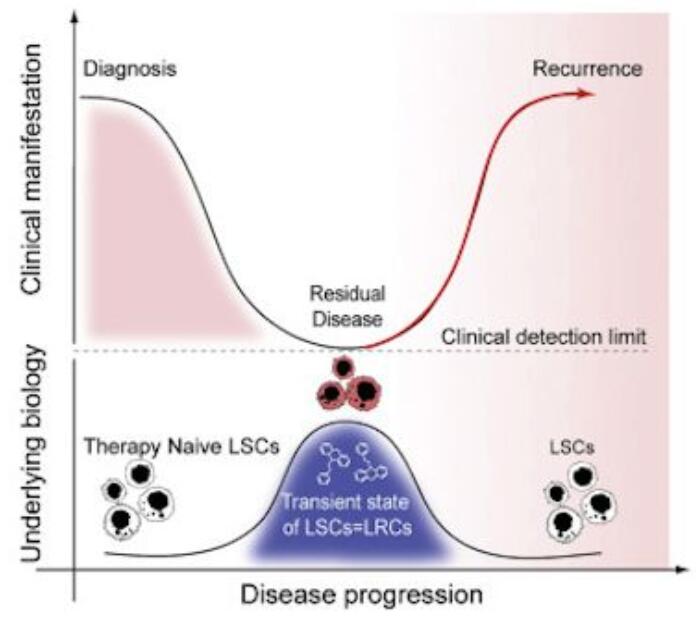
长期以来,癌症研究人员一直认为急性髓性白血病(AML)的复发是由于一群处于休眠状态并且可能免受靶向分裂细胞的化疗影响的白血病干细胞(LSC)。
然而,在一项新的研究中,加拿大麦克马斯特大学的Mickie Bhatia及其同事们分析了患者样本中的癌细胞群体以及从移植到小鼠体内的AML白血病细胞中获得的癌细胞群体,结果发现白血病干细胞在化疗期间消失殆尽。相关研究结果近期发表在Cancer Cell期刊上,论文标题为“Identification of Chemotherapy-Induced Leukemic-Regenerating Cells Reveals a Transient Vulnerability of Human AML Recurrence”。
Bhatia说,“通过这些癌细胞进行动态分析,我们对化疗期间哪些细胞被杀死以及这种癌症如何复发有了更好的了解。”
Bhatia团队在化疗后的多个时间点对患者的骨髓细胞进行采样,与此同时对利用患者的肿瘤培养出的异种移植物也进行采样。在这两类样本中,他们鉴定了一小部分称为白血病再生细胞(leukemic regenerating cell, LRC)的细胞在基因表达谱上与白血病干细胞存在着显著的不同。Bhatia说,“这些白血病再生细胞实际上是化疗反应的产物。”白血病再生细胞仅短暂存在,而且它们的数量随着白血病复发而下降。这些白血病再生细胞的一个显著特征是表达几种G蛋白偶联受体(GPCR)。他们发现抑制白血病再生细胞中特定GPCR基因的表达可阻止接受化疗治疗的小鼠出现癌症复发。
在美国麻省总医院研究AML的David Sykes(未参与这项新的研究)说,“在化疗诱导后,可能存在一个短暂的时间窗口,在这个时间窗口内,人们可能会有一种非常具体的疗法来靶向这一小群白血病再生细胞。”Sykes说,在其他的癌症中发现类似的靶细胞群体的几率是比较高的。
5. 如何维持胚胎干细胞的无限潜能?
DOI: 10.1038/s41467-018-07528-9
胚胎干细胞(ESCs)具有完全的潜能,其能够转化成为机体任何一种类型的细胞,一旦其开始沿着某一特定的路径转化成为某种特定的组织,胚胎干细胞就会失去无限的潜能,如今科学家们尝试理解这一过程发生的方式和原因,旨在开发新型再生疗法,即诱导机体自身的细胞替代受损或疾病的器官。
近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自索尔克研究所的科学家们通过研究开发了一种新型蛋白复合体,其能抑制干细胞的发展,从而使其能够维持无限的潜能;这种名为GBAF的复合体或有望作为后期科学家们开发新型再生医学疗法的潜在靶点。
研究者Diana Hargreaves教授表示,这项研究中,我们始于对胚胎干细胞多能性的探索,这种多能性能够促进胚胎干细胞转化成为机体中任何一种类型的细胞,阐明控制干细胞多潜能性的多种基因网络非常重要,因此能够找到一种在这一调节过程中扮演关键角色的未知蛋白,对于研究者而言也是非常有意义的。机体中的每一个细胞都有着相同的一套DNA元件,其包含有制造每一种可能性细胞类型的指令;大型的蛋白复合体(染色质重塑器)能够激活或沉默基因的表达,指导胚胎干细胞进入到一种特殊的路径中,就好比一群计划装修房子的承包商们,这些蛋复合体也包含有多重亚单位,不同亚单位的组合就能够改变DNA的物理形状,并且决定哪些基因能够指挥干细胞分化成为肺部细胞或大脑细胞。
文章中,研究人员想通过研究深入理解这些亚单位的聚集方式以及特殊的亚单位如何指挥蛋白复合体的功能,因此研究人员转向对一种名为BRD9的蛋白进行研究,该蛋白与BAF染色质重塑器家族有关,他们推测该蛋白或是其中的一种亚单位;随后研究者将BRD9化学抑制剂应用于胚胎干细胞中,并进行了一系列实验来全面分析与BAF复合体活性改变相关的细胞多潜能性。
研究者发现,BRD9能扮演胚胎干细胞发育制动器的角色,当BRD9开始发挥作用时,细胞就会维持多潜能性,而当BRD9的活性被抑制时,细胞就会开始发育的下一个阶段,随后研究者鉴别出了哪种BAF复合体能在细胞中发挥作用,结果表明,BRD9或许是一种未知BAF复合体的一部分。
z1后,研究者Jovylyn Gatchalian说道,这项研究中我们在胚胎干细胞中发现了一种新型的BAF复合体;这项研究中,研究人员在BAF复合体单一突变体的水平下发现了生物化学多样性的存在,这或许能够帮助进行更为广泛的监管控制功能。理解这种控制作用的复杂性对于后期开发多种疾病的再生医学疗法至关重要。
6. Cell Stem Cell:震惊!高达10%的人体血细胞来自肠道中的造血干细胞库
DOI: 10.1016/j.stem.2018.11.007.
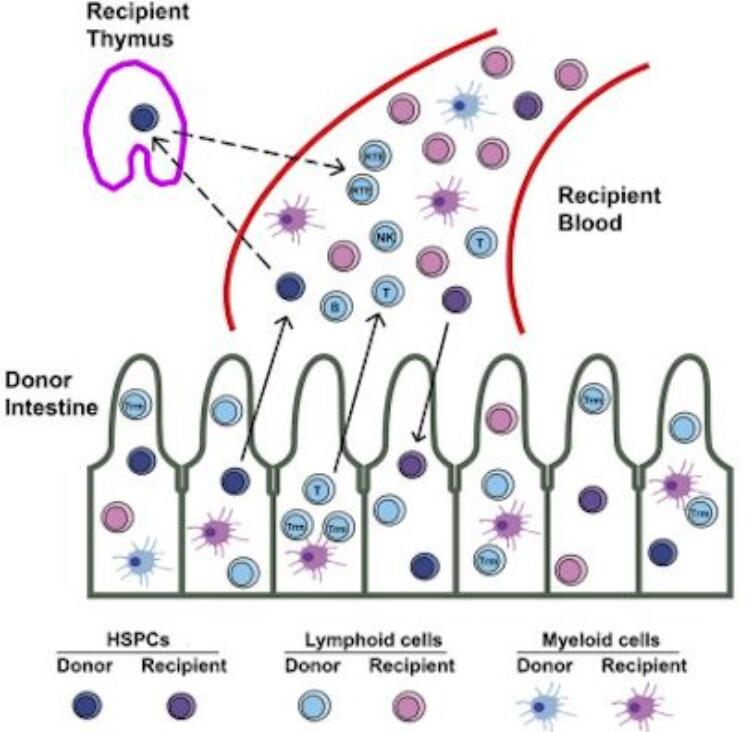
科学家们之前曾认为血细胞是一群特殊的造血干细胞在骨骼中专门产生的。然而,在一项新的研究中,来自美国哥伦比亚大学瓦格洛斯内外科医生学会的研究人员吃惊地发现人体肠道可能利用它自身的造血干细胞库提供高达10%的用于人体循环的血细胞。相关研究结果于2018年10月29日在线发表在Cell Stem Cell期刊上,论文标题为“Human Intestinal Allografts Contain Functional Hematopoietic Stem and Progenitor Cells that Are Maintained by a Circulating Pool”。论文通讯作者为哥伦比亚大学的Megan Sykes。
为什么这比较重要?
如果肠道发生功能障碍,那么肠道移植是患上克罗恩病和其他疾病的患者的唯一的长期治疗选择。但是较高的免疫排斥率和服用免疫抑制药物时产生的危及生命的并发症限制了人类肠道移植的成功率。
当一个人接受移植器官时,免疫系统通常将这种新移植的器官识别为外来物并加以破坏。强效的免疫抑制药物可减轻这些反应,但是这会让患者更容易受到感染和其他并发症的影响。
来自供者的血细胞如何帮助移植受者?
对接受肠道移植的患者的循环白细胞的分析表明,来自供者肠道的细胞会成熟起来并且在受者体内经锻炼后对受者自身组织产生耐受性。同样地,在接受肠道移植后的受者产生的白细胞经锻炼后对供者肠道组织产生耐受性。
Sykes说,“我们清楚地表明这两组血细胞之间的免疫交谈保护肠道移植物免受患者免疫系统的攻击,并且保护患者免于这种肠道移植物的攻击。”
这些研究人员还发现肠道中的造血干细胞z1终会被受者体内的循环造血干细胞库取代。
这些发现如何可能改善移植?
鉴于携带着更多供者血细胞的患者具有较低的器官排斥率,因此这些研究结果指出用于管理器官移植的新策略。
当这些研究人员注意到接受肠道移植的患者的血液含有来自供者的血细胞时,他们发现了肠道中的造血干细胞库。他们追踪到这些供者血细胞的来源:供者肠道中的造血干细胞。
来自供者肠道的造血干细胞产生的血细胞也可能对移植受者有益。患者体内循环的供者血细胞越多,发生排斥肠道移植物的可能性就越小。
Sykes说,“携带着高水平供者细胞的患者可能不像当前这样需要那么多的免疫抑制药物,而且减少免疫抑制药物剂量可能改善治疗结果。”
将来自供者的造血干细胞接种到移植器官中可能也会增加供者-受者交谈和增强对器官移植物产生的耐受性。
Sykes说,“这可能显著地改善移植患者的生活。我们的z1终目标是获得免疫耐受性,这将允许我们无需服用免疫抑制药物就可让患者将移植物视为自我。这真地是这个领域的z1高目标。”
接下来的研究计划
这些研究人员计划在未来试图增加肠道移植期间提供的造血干细胞数量,这有望提高患者体内循环的供者血细胞的水平、免疫耐受性和下降的免疫抑制药物需求。
其他类型的移植可能也受益于类似的干预措施,即使对似乎没有携带自身的造血干细胞库的器官也是如此。
注意事项
这项研究分析了21名接受肠道移植的患者。尽管发现了一种新的造血干细胞群体令人兴奋,但它迄今为止还不能证明改变当前的护理标准是合理的。
7. Blood:科学家成功利用脂肪组织衍生的干细胞制造出人类血小板
doi:10.1182/blood-2018-04-842641
近日,来自日本庆应大学医学院的科学家们开发出了一种新方法,其能在实验室促进脂肪组织衍生的干细胞产生人类血小板,相关研究结果刊登于国际杂志Blood上,该研究表明,人工制造的血小板z1终或能有效减少患者对血小板捐献的依赖性,并帮助癌症和其它疾病患者的康复。
血小板是机体血液中帮助凝血的一种关键组分,对于癌症患者或进行化疗的患者、感染、免疫紊乱以及血小板紊乱的患者而言,输血小板常常能够挽救其生命。每年全球大约有450万单位的血小板被输注,由于捐献的血小板的保质期不足一周时间,因此血小板的供应常常无法满足患者的需求,此外,由于供体的感染和受体出现的免疫反应,捐献的血小板常常也会带来潜在的安全风险。
这项研究中,研究人员基于此前的研究结果通过研究证实,脂肪组织或能用来制造干细胞系,从而只需要12天就能够产生正常功能的血小板;研究者Mastubara表示,脂肪组织衍生的干细胞或许就能够提供一种安全持久的血小板供应,从而满足受体患者不断变化的需求。研究人员z1初试图从另外两类干细胞中衍生提取血小板,其中一类就是诱导多能干细胞;研究者指出,脂肪组织衍生的细胞能够产生巨核细胞和血小板尺寸大小的细胞,这些细胞在天然状态下能表达多种对血小板产生非常重要的基因。
当研究者对诱导脂肪衍生的干细胞产生血小板的技术进行优化后,他们进行了一系列实验来检测是否这种人工制造的血小板的功能与天然的人类血小板功能类似,结果表明,这种在实验室中生长的血小板含有天然血小板表面的标志性蛋白,同时还含有促进凝血过程的特殊颗粒,随后研究者利用小鼠进行血凝模拟实验,结果表明,这些血小板的行为与供体捐赠的血小板非常像,其能够聚集形成凝块。
z1后研究者Matsubara表示,相比供体来源的血小板而言,尽管这种制造血小板的成本更高,但本文研究结果表明,通过一种简单的方法或许就能通过脂肪衍生的细胞来制造血小板。如今研究人员已经建立了一套有效的制造大量脂肪衍生血小板细胞的人工过程,下一步他们计划利用动物模型开展临床前试验,随后再进行人类机体的临床试验。
8. 新型干细胞疗法有望彻底根治白血病
DOI: 10.1126/scitranslmed.aat8410
干细胞移植能有效治疗白血病,然而在很多情况下,来自供体的免疫细胞却会攻击受体患者机体的健康组织,从而产生致死性的后果,近日,一项刊登在国际杂志Science Translational Medicine上的研究报告中,来自苏黎世大学等机构的科学家们通过研究鉴别出了一种在该过程中扮演关键作用的特殊分子,阻断该分子的功能就能明显改善接受干细胞移植疗法患者的预后状况。
干细胞疗法能为白血病或骨髓癌症患者完全康复带来希望,这一疗法需要去除患者因接受化疗或放疗所影响的细胞,随后利用健康供体机体中的血液干细胞来替代这些细胞,这些供体细胞能够产生新的血细胞,并攻击患者机体中的癌变细胞,从而抑制癌症的复发。
危险的反应
然而,这种疗法并不是没有风险,在30%-60%的病例中,来自供体的细胞常常会攻击受体机体的健康组织,尤其是肝脏、肠道组织及皮肤组织等;在大约一半受影响的患者中,诸如移植物抗宿主反应甚至会给患者带来致死性的后果,这也就是为何临床医生常常会采用抑制免疫系统功能的药物来抑制这些反应的原因了。这一疗法存在局限性或缺点,其同时还能够降低供体细胞对患者机体癌细胞的抗癌效应,因此目前研究人员急需通过研究理解如何在不降低移植细胞抗癌效应的前提下减少移植物的抗宿主反应。
负责进行攻击的细胞因子
这项研究中,研究人员通过联合研究发现,在移植物抗宿主病理学表现中,名为GM-CSF的细胞因子的产生具有决定性的作用,GM-CSF由一类特殊的白细胞产生,其能帮助抵御健康人群机体中的感染。文章中,研究者利用小鼠模型进行研究发现,在移植物抗宿主反应期间这些移植的细胞会产生大量的GM-CSF因子,如果给与小鼠机体注射了无法产生GM-CSF的供体细胞,那么小鼠就会免于致死性反应的产生,因此靶向作用这种细胞因子就能产生一种精准化、特异性的免疫抑制效应,这或许就有望阻断移植物抗宿主反应所造成的组织损伤。
起初研究人员比较担心,中和GM-CSF因子会减少供体细胞的抗癌效应,然而后期深入研究后他们发现,实际情况或许并不是那样;研究者Sonia Tugues说道,实际的研究结果让我们非常惊讶,此前我们认为所有类型的免疫反应都是由相同的机制所介导的,如今我们发现了一种方法能从供体细胞中将想要的过程与不需要的过程相分离。
将小鼠机体的研究结果转化到人类临床试验中
随后研究者想通过研究阐明GM-CSF因子在人类机体中和小鼠机体中是否扮演着相同的关键角色,通过对来自患者机体中受移植物抗宿主反应的组织进行分析后,研究者发现的确如此,这些样本中GM-CSF的水平较高,当患者移植物抗宿主反应较强时,受影响组织中GM-CSF因子的水平也会相应升高。
目前研究人员希望能够进行临床试验来检测是否阻断GM-CSF因子的功能就能抑制受体患者在干细胞移植后出现的移植物抗宿主反应;目前研究者已经联系了一家能开发阻断GM-CSF单克隆抗体的公司,研究者Becher表示,如果能够在阻断移植物抗宿主反应的同时能保留抗癌效应的话,这一过程或许就能成功改善患者的预后,并给患者带来较小的副作用,这种治疗性的策略或许有望帮助改善预后较差或面临致死性风险患者的健康状况。
上一篇:我国干细胞临床治疗时代已经开始
了解详情请拨打:400-6060-992